基因谷
2017-12-18 11:29
据奇点网报道,在当下液体活检风头正盛的时候,约翰霍普金斯大学医学院的两位研究人员却在《JAMA Oncology》杂志上发表研究指出,不同机构进行的检测得到的结果差异非常大,两家权威机构同时检测的40名患者样本中,除去6例检测结果被认为无效的外,其余34例中测序结果完全一致的只有12例[1]!

来自约翰霍普金斯大学医学院的两位研究人员,Gonzalo Torga(左)和Kenneth J. Pienta(右)
需要注意的是,两家机构检测的基因和位点都有一些差异,因此研究人员只比较了两家公司的检测中共有的、重合的位点。基于这一结果,他们认为这一结果值得科学家们深思,究竟该怎样改善现有的方法才能更好地帮助到患者。
在这次的研究中,“接受考验”的两家机构分别是Guardant Health和Personal Genome Diagnostics,两家的检测产品会分别对患者血液样本中的73个基因和64个基因的部分编码序列进行测序。

绿:两家检测都发现的重合的突变位点,灰:没有检测到突变的位点,红:两家重合的检测位点中只被其中一家检测到的,蓝:其中一家特有的检测位点被检测到突变的;P代表Personal Genome Diagnostics,G代表Guardant Health
Personal Genome Diagnostics的创始人是约翰霍普金斯大学Kimmel癌症中心的肿瘤学教授Luis Diaz,在癌症领域有超过25年的研究经验[2],在2010年成立了Personal Genome Diagnostics。而Guardant Health可能更加为业内人士所熟悉,在成立的4年中,他们共获得了5.5亿美元的投资,还在2014年被达沃斯评为了“24家正在改变未来的公司”之一[3]。
研究人员招募了40名患转移性前列腺癌的患者,抽取了血样后,分成两份分别送到两家的实验室进行测序。在这40例样本中有6例因为某些原因检测结果被认定无效,剩下的34例中,有12例(35%)检测报告给出的结果相同,其中有3例突变谱完全一致,其余9例均没有检测到突变。剩下的22名患者就没这么“好的运气”了,他们中有6例检测到的突变有重合,但是又不完全相同,还有16例检测到的突变完全不重合。
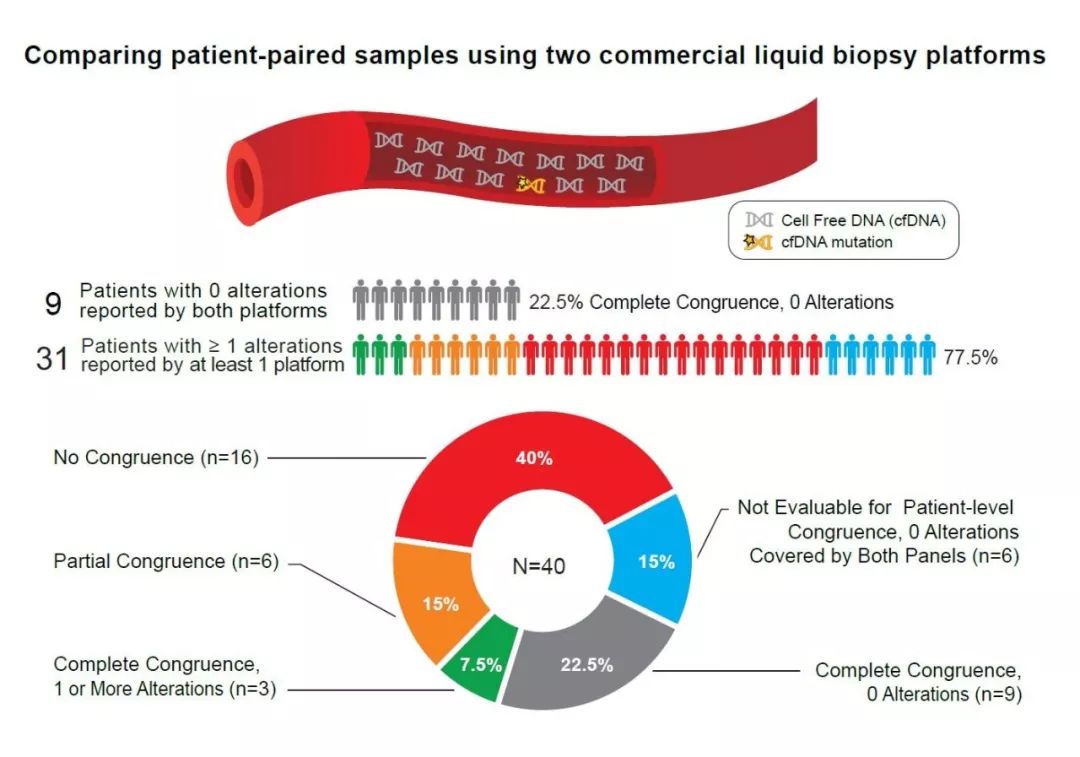
40名患者的检测结果,16例(红)为两家检测到的突变完全不重合,6例(橙)为部分重合但不完全相同,3例(绿)为突变谱完全重合,9例(灰)为经两家检测均没有发现突变,6例(蓝)为检测结果无效
这个结果让研究人员非常惊讶,两家公司都是业内顶尖的,他们的实验室也都获得了临床检验改进修正计划(Clinical Laboratory Improvement Amendments,CLIA)的认证,CLIA认证意味着实验室中临床试验结果的准确性、可靠性和时效性都得到了FDA和CDC等的认可,并且他们也都拥有美国病理学会的CAP(College of American Pathologists)认证,“两证俱全”。
研究人员的本意也是希望为患者提供最好的选择,所以才找了两家公司提交样本,进行比较,但是这个结果让他们也很意外[4]。这也和今年早些时候同样发表在《JAMA Oncology》上的另一篇文章[5]“不谋而合”。
这项研究由华盛顿大学医学院的研究人员领导,他们招募了9名癌症患者(5名为乳腺癌,其余4名分别为胰腺癌、胸腺癌、肺癌和唾液腺癌),同样选择了两家液体活检公司对患者的血液样本进行了检测。其中一家是和这次一样的Guardant Health,另一家是Foundation Medicine,同样也是大名鼎鼎,曾为乔布斯老爷子进行过测序,创始人是人类基因组计划的领导者之一,他们的检测会包括315个癌症相关基因的外显子以及28个重排基因的内含子。

然而,2份测序结果也有不小的差异。其中胸腺癌患者在两家都没有检测到突变,剩下的8名患者中共检测到了45个突变,其中只有10个(22%)是重合的,而且8名患者中有2名检测到的突变完全不同。
这是不是说明这些检测“不靠谱”呢?但是和新研究同期刊发的另一篇文章似乎又给予了否定的回答。在研究中,研究人员使用FDA批准的伴随诊断(FDA-CD)和实验室自主开发的检测(LDT)分别对6897例样本的BRAF、EGFR和KRAS基因的突变情况进行了检测[6]。前面我们提到的几家公司的测试就属于LDT的范畴。与需要FDA进行认证,可以商用的FDA-CD相比,LDT是由各实验室自己进行研发和验证的,技术和检测只能在自己的实验室内使用,不需要FDA认证。
不过在这个研究中,研究人员发现,FDA-CD和LDT的检测结果重合度是非常高的,按照美国病理学会的实验室能力比对验证(Proficiency Testing,PT)给出的结果,两种检测都有超过97%的准确率。基于这个结果,研究人员认为FDA所希望的,加强对LDT的检测和监管可能是不必要的。LDT与FDA-CD的检测结果几乎完全相同,那么似乎说明,LDT在检测样本上的能力已经很合格了,但是前面两个研究中,两家LDT的结果偏差如此之大,与这个研究得到的结果一定程度上是相悖的。
在同期杂志中,密歇根大学综合癌症中心的Daniel F. Hayes博士还为此撰写了一篇评论文章[7],他认为后者的研究只涉及到了3个在癌症患者中极其常见的突变基因,这个结论不能推及到更多的基因和检测上。

Daniel F. Hayes博士
回顾了两个结论相悖的新研究后,Hayes博士提出了问题:究竟哪个是“事实”?没有人知道答案。他认为约翰霍普金斯大学医学院两位研究人员的研究成果应该得到特别重视,因为“一次糟糕的肿瘤标志物检测带来的后果和糟糕的药物一样”,而现在患者所用的检测多是LDT,如果检测结果的准确性不能得到保证的话,那对于患者来说是非常可怕的一件事情。
Hayes博士表示,开发LDT的公司和实验室不能抱有“一经售出,概不负责”的态度,他将联合其他研究人员,呼吁技术的研发者去验证、改善这些被广泛用于患者的检测方法。
早在2016年,测序中国就对两家商业测序公司的癌症基因检测结果差异显著进行了报道

华盛顿大学Tony Blau带领的研究人员对9名患者接受Foundation Medicine公司的FoundationOne检测和Guardant Health公司的Guardant360检测的结果进行分析,关于患者的肿瘤含有的基因变异或者应该采取的治疗方法,两家检测的结果并不总是一致。初步研究结果发表在《JAMA Oncology》上。
Blau和同事们发现两家公司的检测报告中仅22%的变异相同。虽然一家公司的检测可能揭示更广泛的变异,但研究者表示,造成这种差异的原因是由于肿瘤异质性和公司如何决定所报告变异的差异导致。
作者们写道,“我们的研究结果表明,基因检测的结果可能会有显著差异,取决于应用哪种检测。”
两个平台的癌症基因检测结果中仅22%的变异相同
虽然FoundationOne和Guardant360检测都是对临床癌症样本进行测序,但是两者的检测方法有所不同。FoundationOne是对组织样本中315个癌症相关基因的外显子和28个与重排相关基因的内含子进行测序。而Guardant360是对血液样本中发现的循环游离DNA中的约70个基因进行测序。这两项检测的特异性都超过99%,但敏感性稍低。
Blau等人招募了9名接受过这两项检测的患者。其中5人患有乳腺癌,其他人分别患有胰腺癌、胸腺癌、肺癌和唾液腺癌。
这两项检测都没有发现胸腺癌患者的任何遗传变异,在另外八名患者中共检测到45个突变,但其中只有10个突变,即22%同时被检测到。这八名患者中的两名通过检测发现的突变之间没有重叠。
这两项检测还根据检测结果对患者进行药物推荐。总的来说,这两项检测共推荐了36种药物,对同一患者推荐的药物中仅有9种是相同的,对5名患者推荐的药物中没有重叠的。然而,只分析两项检测报告了相同突变结果的患者时,推荐药物之间的一致性增加至62%。
检测结果不一致的潜在原因
研究者们分析了这两项检测结果不一致的许多潜在原因。FoundationOne检测的突变范围比Guardant360更广泛,但研究者没有分析只被FoundationOne捕获的变异。另一个可能的原因是患者接受检测的时间,但8名患者中有7名是在10周内接受了这两种检测。
排除了上述原因后,其他潜在的原因为肿瘤异质性、公司对变异报告标准的差异,以及检测所用样本的差异。
研究人员指出,Guardant360检测通常会报告低频变异。当他们只分析Guardant360检测发现的频率高于1%的变异时,这两种检测之间的一些不一致消失了。
两家公司如何看
Foundation Medicine公司的首席医疗官Vince Miller认为,肿瘤的异质性并不如想象中的那么高。来自同一肿瘤不同位点的样本通常高度一致,而且在大多数情况下,单次活检就可以捕获到关键变异。这项研究中差异产生的原因可能是,肿瘤不以恒定的速率排出细胞并被液体活检方法捕获到。这样的结果让他们坚持使用组织样本进行检测。
相反,Guardant Health公司的高级医学主任、实验室主管Justin Odegaard认为,液体活检捕获的低频变异代表着实体瘤或甚至是转移瘤的异质性。这项研究表明不同的检测方法可能是互补的。两种技术都检测到了对方未检测到的结果,它们可以为患者提供可能的最好的治疗。
参考资料:
[1] Patient-Paired Sample Congruence Between 2Commercial Liquid Biopsy Tests
[2]
http://www.personalgenome.com/board-of-directors/
[3]
https://www.weforum.org/agenda/2 ... anging-your-future/
[4]
https://www.hopkinsmedicine.org/ ... tween_two_providers
[5] Kuderer N M, Burton K A, Blau S, et al. Comparison of 2 commercially available next-generation sequencing platforms in oncology[J]. JAMA oncology, 2017, 3(7): 996-998.
[6] Comparison of Laboratory-Developed Testsand FDA-Approved Assays for BRAF, EGFR, and KRAS Testing
[7] Precision Medicine and Testing for Tumor Biomarkers— Are All Tests Born Equal?
声明:本文由入驻搜狐号的作者撰写,除搜狐官方账号外,观点仅代表作者本人,不代表搜狐立场。
延伸阅读:
癌症新突破:沉默的“垃圾”基因,可以阻止肿瘤的生长!
基因谷
2017-12-16 11:35

在研究了人类基因组未被探索的区域之后,研究人员发现了一种新的非编码基因,它似乎在癌症的发展中起着重要作用。
该基因位于基因组的一个区域,不包含制造蛋白质的指令。有一次,有人认为这个非编码区只是无关紧要的“垃圾”。
然而,随着技术的进步,越来越多的基因被发现在这个“暗物质”中,这对健康和疾病都是重要的。
在《细胞》杂志,科学家报告说,虽然新的基因并没有编码蛋白质,但它对癌细胞有“直接影响”。他们发现沉默可以阻止肿瘤的生长。
DNA和RNA,基因组和转录组
人类基因组包含建立和维持细胞所需的所有指令。它携带着这一信息,在一个叫做DNA的长、弯曲、双链分子中,有20000 - 25000个基因。
DNA中包含的指令并不是直接从那里得到的。它首先被“转录”成一个被称为RNA的单链分子,它反映了DNA序列,并且所有在细胞中保存的转录本被称为细胞的“转录组”。
因此,虽然基因组很少因细胞而异,但转录组的变化取决于细胞的类型。
通过对RNA的分析,研究人员应该能够发现在不同的细胞中DNA的基因是如何和何时被开启和关闭的。
例如,分析转录组可能会发现,一个未知的基因在癌细胞中高度表达,而不是在健康细胞中。这可能表明该基因对细胞生长很重要。
非编码基因不一定是“垃圾”
转录组被保存在几种不同的RNA中。主要的信使RNA(mRNA)携带的是制造蛋白质的脚本或代码,这些蛋白质是在细胞中做大量工作的分子。非编码rna携带从DNA中转录而不是合成蛋白质的脚本。
很长一段时间以来,人们都认为不含制造蛋白质指令的大部分基因组是垃圾DNA。这些所谓的非编码基因也被称为暗物质,因为人们对它们知之甚少。
但随着测序技术的进步,科学家们发现,虽然基因组的暗物质可能不会最终产生蛋白质,但它确实产生了非编码rna,在健康和疾病的细胞生物学中发挥着重要作用。
在过去的20年里,发现了许多新的非编码RNA,其中包括一种称为长非编码RNA的RNA(lncRNA),它是一种有超过200个构建块或核苷酸的RNA链。
在新的研究报告中,研究人员描述了他们如何发现并描述了一个lncRNA,他们发现它们在斑马鱼、老鼠和人类身上都是一样的。
这引起了他们的好奇心,因为在不同物种间发现这种“保守”的RNA是罕见的。这是否意味着它在细胞生物学中发挥了重要作用?
他们将lncRNA命名为“睾丸相关的高度保守的长非编码RNA”(THOR)。
资深研究作者、密歇根大学(Michigan Medicine)的病理学教授Arul Chinnaiyan说,他们决定把注意力集中在THOR身上,因为它似乎“被进化选择了重要的功能。”
研究人员发现,高度保守的lncRNA对癌症的发展非常重要,沉默阻止了肿瘤的生长。
THOR在癌细胞中高度表达
在之前的研究中,他们已经确定了数千种潜在的lncrna,这些潜在的lncrna在绘制暗物质的图景后可能会更有用。他们选择研究THOR有两个原因:第一,因为它是“进化高度保守的”,其次,因为它只在一种正常的成人组织中高度表达:睾丸。
Chinnaiyan教授说,因为在斑马鱼和人类和老鼠身上,THOR是高度保守的,所以他们能够研究它在斑马鱼模型中的作用。
但是,当他们进一步调查THOR时,他们发现它在某些癌症,特别是黑素瘤和肺癌中也有很高的表达,并且它在癌症的发展中起到了直接的作用。
使用实验室培育的癌细胞表达THOR的实验表明,沉默该基因会减缓肿瘤的生长,而过度表达则会加速肿瘤的生长。而且,正常细胞缺乏THOR的正常发育,表明它只对癌细胞有影响。
沉默THOR“抑制细胞增殖”
Chinnaiyan教授说,他们经历了“很多lncrna”,其中大多数没有显示出像THOR这样的清晰的功能。
在进一步的实验中,研究小组发现,THOR与胰岛素样生长因子结合蛋白(IGFBPs)相互作用,后者被认为有助于保持rna的稳定。他们发现沉默的THOR阻止了IGFBPs的活动。
Chinnaiyan教授说:“如果我们扰乱了THOR的功能,我们就会破坏稳定RNA的能力。”抑制细胞增殖。研究人员还发现,过度表达THOR会使细胞生长得更快。
他们认为,THOR可能是抗癌药物的靶点,因为它不会干扰健康细胞。
“我们发现THOR是一个高度保守的lncRNA,这是令人兴奋的事实。”(白木清水207609)
声明:本文由入驻搜狐号的作者撰写,除搜狐官方账号外,观点仅代表作者本人,不代表搜狐立场。
![SiS001! Board - [第一会所 关闭注册]](images/green001/logo.png)



